أوراق عمل علوم محلولة الثاني المتوسط الفصل الأول أ.بندر المطيري
-
2022-12-28
- |
- | مشاهدات: 2767
أوراق عمل علوم محلولة الثاني المتوسط الفصل الأول أ.بندر المطيري
الدرس الاول : اسلوب العلم
رقم الصفحة في الكتاب : 18 -20
السؤال : تعريف العلم :
الجواب : هو أسلوب لفهم العالم من حولنا.
الاثار : هو العلم الذي يدرس الأدوات وما خلفته حضارة الانسان .
السؤال : فروع علم الآثار ( اقسامه ):
الجواب :
١ -دراسة الانسان الذي عاش قبل تدوين التاريخ
٢ -دراسة الحضارات التي نمت مع بداية تدوين التاريخ
التقنية : هي استعمال المعرفة العلمية للحصول على منتجات و أدوات جديدة .
السؤال : اشكال التقنية :
الجواب :
١ -الحاسب الالي
٢ -آلات التصوير
٣ -الرادار
ملحوظة : العمل الميداني والعمل المختبري كلا هما مهم في الدرسات العلمية
الدرس الثاني : حل المشكلات بطريقة علمية
رقم الصفحة في الكتاب : 22 - 26
الطرائق العلمية : خطوات أو طريقة يتم إتباعها لحل المشكلات
السؤال : أكتب خطوات الطريقة العلمية :
الجواب :
1- الحواس : هي الحصول على معلومات باستخدام الحواس
2- الاستنتاجات : هي النتائج المستخلصة من خلال الملاحظات
3- الفرضية : .هي عبارة يمكن تخمينها .
* عوامل اجراء التجربة :
١ ــ الثوابت : هي عوامل لا تتغير أثناء التجربة .
٢ ــ المتغير المستقل : هو العامل الذي يتم تغييره أثناء التجربة .
٣ ــ المتغير التابع : هو العامل او الناتج الذي يمكن قياسه اثناء التجربة .
٤ ــ العينة الضابطة : هو معيار يمكن استخدامه للمقارنة مع نتائج التجربة .
*تحليل البيانات / هي رسوم بيانية او أعمدة تعبر عن مقادير ( اكبر / اقل / اسرع )
*استخلاص النتائج والتواصل / نشر ماتم التوصل اليه
تقويم : العلم و تفاعلات الاجسام
رقم الصفحة في الكتاب : 18 -33
السؤال : حدد الإجابة الصحيحة
1 عوامل لا تتغير اثناء التجربة
A الثوابت ( صح )
B العامل المستقل
C الفرضية
D العامل التابع
2 عوامل تتغير اثناء التجربة
A العينة الضابطة
B الفرضية
C المتغير المستقل ( صح )
D الثوابت
السؤال : اذكر اثنين من اشكال التقنية المستخدمة في علم الاثار ؟
الجواب :
١ -الرادار
٢ -الحاسب الالي
السؤال : ضع المصطلح العلمي المناسب امام كل جملة ؟
| م | التعريف | المصطلح |
| 1 | أسلوب لفهم العالم من حولنا | العلم |
| 2 | عبارة يمكن فحصها واختبارها | الفرضية |
| 3 | هو العلم الذي يدرس الأدوات وما خلفته حضارة الانسان |
الآثار |
الدرس الثالث : المحاليل و الذائبية
رقم الصفحة في الكتاب 38 - 39
المادة النقية : هي مادة لها نفس الخصائص ولايمكن تجزئتها الى مواد ابسط بواسطة العمليات الفيزيائية مثل العنصر والمركبات
تعريف المخاليط : هي مواد غير نقية وغير مرتبطة والنسب بين مكوناتها غير محدده
ويمكن فصلها بالعمليات الفيزيائية
السؤال : أنواع المخاليط
| م | المخاليط | تعريفها | فصلها | مثل |
| 1 | المخاليط الغير متجانسة | هي مخاليط تكون في المواد غير موزعة بانتظام , ولا تمتزج فيها المواد بشكل منتظم |
يسهل فصل مكوناتها |
السلطة المكسرات البتزا برادة الحديد و الرمل |
| 2 | المخاليط المتجانسة | هي مخاليط تكون فيها المواد مختلطة بشكل تام ومنتظم دون ان ترتبط بروابط كيميائية |
يصعب فصلها |
الشامبو العصير السكر و الماء |
ملاحظة مهمة ** يسمى المخلوط المتجانس (( محلول ))
الدرس الرابع تابع المحاليل والذائبية
رقم الصفحة في الكتاب : ٣٩ - ٤١
المحلول : هي مخاليط متجانسة تكون فيها المواد مختلطة بشكل تام ومنتظم دون ان
ترتبط بروابط كيميائية .
السؤال : مكونات المحلول :
١ -المذيب هي المادة التي تذيب المذاب
٢ -المذاب هي المادة التي تذوب وكأنها اختفت
ملحوظة مهمة ** المحلول ذو الكمية الأكبر هو المذيب والمحلول ذو الكمية الأقل المذاب
أنواع المحاليل :
| نوع المحلول | المذيب | المذاب | أمثلة |
| 1-المحاليل السائلة | سائل | سائل غاز صلب |
الخل والماء حمض الخليك المشروبات الغازية السكر و الماء |
| 2-المحاليل الغازية | غاز | سائل غاز صلب |
بخار الماء في الهواء الاكسجين في الهواء الغبار في الهواء |
| 3 -المحاليل الصلبة | صلب |
سائل غاز صلب |
الزئبق والفضة ------ الكربون والحديد ( الفولاذ ) |
المحاليل المائية : هي المحاليل التي يكون فيها الماء مذيبا
الدرس الخامس الروابط التساهمية والايونية
رقم الصفحة في الكتاب : ٤١ - ٤٣
الروابط التساهمية :
| تعريف الرابطة التساهمية | هي روابط كيميائية ناتجة عن المشاركة بالالكترونات |
| أنواعها | ١-مشاركة متساوية بالالكترونات وتعطي جزيئات غير قطبية
مثل جزئ الهيدروجين ٢ -مشاركة متساوية بالالكترونات وتعطي جزيئات قطبية مثل جزئ الماء |
| ملاحظة | تسمى المركبات التي فيها هذا النوع من الروابط المركبات الجزيئية |
الروابط الايونية :
| تعريف الرابطة الايونية | هي روابط كيميائية ناتجة عن فقد احدى الذرات واكتساب ذرة اخرى |
| مثال | كلوريد الصوديوم NaCl |
| ملاحظة | تسمى المركبات التي فيها هذا النوع من الروابط المركبات الايونية |
السؤال : كيف يذيب الماء المركبات الايونية ؟
الجواب :
الماء جزي قطبي حيث يكون طرف الهيدروجين موجب وطرف الاكسجين سالب وبالتالي فانه
يتجاذب مع الايونات السالبة والموجبة للمركبات الايونية . فتنفصل ايونات المركب الايوني بفعل
جزيئات الماء
السؤال : كيف يذيب الماء المركبات التساهمية ؟
الجواب :
يتخلل الماء جزيئات المركبات الجزيئية فينفصل بعضها عن بعض مثل جزيئات السكر التي
تنفصل وتنتشر بين الجزيئات
ملحوظة مهمة ** المثل يذيب المثل ( السكر يذوب في الماء )
الزيت لايذوب في الماء ( لان الماء قطبي والزيت غير قطبي )
الدرس السادس الذائبية
رقم الصفحة في الكتاب : 43 -46
السؤال : تعريف الذائبية :
الجواب : هي كمية المادة التي يمكن اذابتها في كمية محدده من المذيب.
السؤال : العوامل المؤثرة في سرعة الذوبان
الجواب :
١ -التحريك
٢ -زيادة درجة الحرارة
٣ -سحق وطحن المذاب
السؤال : تعريف المحلول المشبع :
الجواب : هو محلول يحوي على الكمية الكليه من المذاب والتي يمكن اذابتها في ظروف معينة
السؤال : تعريف التركيز :
الجواب: هي كمية المذاب بالنسبة الى كمية المذيب في المحلول
الدرس الثامن : المحاليل الحمضية
رقم الصفحة 48 -50
المحاليل الحمضية
| تعريف الاحماض | هي مواد تطلق ايونات الهيدروجين الموجب عند ذوبانها في الماء |
| خصائص الاحماض | ١ -طعمها لاذع وحامض ٢ -كاوية وحارقه للجسم ٣ – موصلة للكهرباء ٤ – تتفاعل بقوة مع الفلزات |
| استخداماتها |
* في الطعام مثل حمض الخل * في تكون الكهوف مثل حمض الكربونيك |
أمثلة على الاحماض
| أحماض قوية | أحماض ضعيفة |
|
*حمض الهيدروكلوريك * حمض الكبريتيك * حمض النتريك |
*. حمض الخل *حمض النتريك |
الدرس التاسع : المحاليل القاعدية
رقم الصفحة في الكتاب : 51 -51
المحاليل القاعدية
| تعريف القواعد |
هي مواد تطلق ايونات الهيدروكسيد عند ذوبانها في الماء أو ( مواد تتقبل وتستقبل ايون الهيدروجين الموجب عند ذوبانها في الماء ) |
| خصائص القواعد |
١ -طعمها مر ٢ -كاوية وحارقه للجسم ٣ – موصلة للكهرباء ٤ – تتفاعل مع الفلزات بشكل اقل من الاحماض 5 -ملمسها زلق مثل الصابون |
| استخداماتها | * في مستحضرات التنظيف * في تخطيط الملاعب مثل هيدروكسيد الكالسيوم * في المنظفات وتسليك المجاري مثل هيدروكسيد الصوديوم |
أمثلة على القواعد
| قواعد قوية | قواعد ضعيفة |
| هيدروكسيد الصوديوم هيدروكسيد البوتاسيوم |
هيدروكسيد الحديد الامونيا |
الدرس العاشر : الرقم الهيدروجيني
رقم الصفحة في الكتاب : 25 -55
الرقم الهيدروجيني ph : هو مقياس لحمضية وقاعدية المحلول ويتدرج من ١ الى ١٤
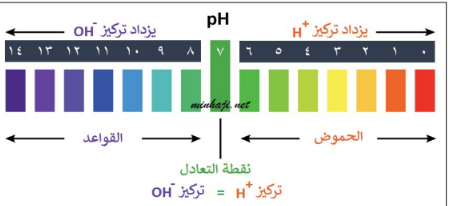
يتدرج الرقم الهيدروجيني من . ( ١ ) الى( ١٤ )
الرقم ( ٠ ) يمثل الأقوى حامضية مثل حمض الهيدروكلوريك
الرقم ( ٧ )يمثل التعادل مثل الماء
الرقم ( ١٤ ) يمثل الأقوى قاعدية مثل هيدروكسيد الصوديوم
الكواشف : هي مركبات تستخدم للكشف عن المحاليل الحمضية والقاعدية من خلال
تغير لونها باختلاف الرقم الهيدروجيني .
من الكواشف المستخدمة ورق تباع الشمس و الملفوف الاحمر
التعادل : هو تفاعل حمض مع قاعدة ينتج عنه ماء وملح
معادلة التعادل : حمض + قاعدة ـــــــــــ ملح + ماء
تقويم : المحاليل والذائبية
رقم الصفحة في الكتاب : ٣٨ -٦٣
السؤال : حـدد الإجـابـة الـصـحـيـحـة:
1 من طرق زيادة معدل سرعة ذوبان المواد الصلبة في السائلة
A التحريك
B التسخين
C السحق والطحن
D جميع ما سبق ( صح )
2 هو مقياس لحمضية او قاعدية المحلول
A التركيز
B الرقم الهيدروجيني ( صح )
C التعادل
D لا شيء مما سبق
3 طعمها لاذع و موصلة للكهرباء وتتفاعل مع الفلزات
A المحاليل الحمضية ( صح )
B المحاليل القاعدية
C المركبات التساهمية
D لا شيء مما سبق
4 يستخدم في تنظيف المعادن
A هيدروكسيد الكلوريك
B حمض الهيدروكلوريك ( صح )
C حمض الستريك
D الخل
السؤال : اذكر أنواع المخاليط والفرق بينهم ؟
الجواب : مخلوط متجانس ، مخلوط غير متجانس
الإجابة مفتوحة
السؤال : ضع المصطلح العلمي المناسب امام كل جملة ؟
| م | التعريف | المصطلح |
| 1 | المادة التي تذوب وكأنها اختفت | المذاب |
| 2 | هو مقياس لحامضية وقاعدية المحلول | الرقم اليهدروجيني |
| 3 | هي مركبات تستخدم للكشف عن المحاليل الحمضية والقاعدية من خلال تغير لونها باختلاف الرقم الهيدروجيني |
الكواشف |
السؤال : اذكر أنواع المحاليل :
الجواب : 1-الصلبة ٢ -السائلة ٣ -الغازية
الدرس الحادي عشر : المادة
رقم الصفحة في الكتاب 70 -73
المادة : هي كل شي يشغل حيز وله كتله
السؤال : حالات المادة أربع هي :
الجواب : ١ ـ الصلبة ٢ ـ الغازية ٣ ـ السائلة ٤ ـ البلازما
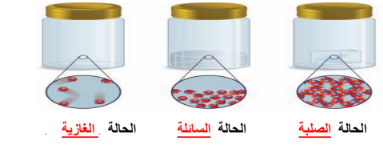
السؤال : ما الذي يحدد حالة المادة
الجواب :
١ -حركة جسيمات المادة
٢ -قوة التجاذب بين الجسيمات
| الحالة | الحالة الصلبة | الحالة السائلة | الحالة الغازية |
| الشكل | ثابت | متغير | متغير |
| الحجم | ثابت | ثابت | غير ثابت |
| قوة التماسك | قوية | متوسطة | ضعيفة |
| الحركة | اهتزازية | الجريان | الانتشار |
مواد صلبة بلورية : هي مواد تترتب الجزيئات فيها بشكل منتظم ومتكرر في المادة
مثل: السكر و الالماس و الثلج
مواد صلبة غير بلورية : هي مواد ترتيب الجزيئات فيها بشكل عشوائي في المادة
مثل : المطاط و البلاستيك و الزجاج
الدرس الثاني عشر : تابع المادة
رقم الصفحة في الكتاب 73 -74
اللزوجة : هي مقاومة السائل للجريان والانسياب
مثل : العسل و الزيت
ملاحظة : تقل لزوجة السائل مع ارتفاع درجة الحرارة والعكس صحيح
التوتر السطحي : هو قوة غير متوازنة تئثر في جسيمات سطح السائل فيبدو كغشاء مرن مشدود
مثل استقرار بعض الحشرات على سطح السائل
الحالة البلازما :
هي احد حالات المادة وتحدث عن درجة الحرارة العالية مثل الشمس و البرق و أضواء النيون
الدرس الثالث عشر : الحرارة وتحولات المادة
رقم الصفحة في الكتاب : ٧٥-٨١
** جسيمات المادة لها نوعين من الطاقة طاقة الحركة و طاقة الوضع
تعريف الطاقة الحرارية : هي مجموع طاقتي الوضع والحركة لجميع جسيمات الجسم .
تعريف درجة الحرارة : هي متوسط الطاقة الحركية للجسيمات المكونة للجسم .
تعريف الحرارة : هي عملية انتقال الطاقة الحرارية من الجسم الاسخن الى الجسم الابرد.
الحرارة النوعية هي كمية الحرارة اللازمة لرفع درجة حرارة ١جم من مادة نقية درجة مئوية واحدة
**ملاحظة مهمه " كلما كانت الحرارة النوعية للمادة النقية عالية فإنها تبرد وتسخن ببطء "
أعلى المواد حرارة نوعية هو الماء
** التغيرات بين حالات المادة :
السؤال : الرسم التالي يبـين تحولات حالات المادة ؟
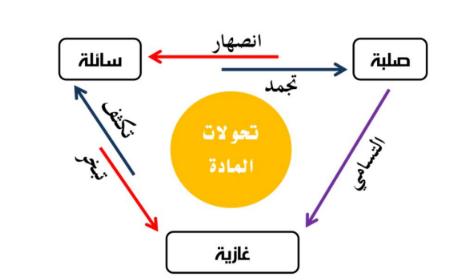
ملاحظة
في ( الانصهار و التبخر والتسامي ) تكتسب المادة طاقة حرارية
في ( التجمد و التكثف ) تفقد المادة طاقة حرارية
الدرس الرابع عشر : تابع تحولات الحرارة
رقم الصفحة في الكتاب 78 -81
السؤال : في الجدول التالي ضع الرقم من العمود ( أ ) أمام ال عبارة المناسبة في العمود ( ب ) :
| أ | اسم الحالة | الرقم | ب |
| 1 | التبخر | 3 | تحول المادة من الحالة الصلبة الى السائلة |
| 2 | التكثف | 1 | تحول المادة من الحالة السائلة الى الغازية |
| 3 | الانصهار | 4 | تحول المادة من الحالة السائلة الى الصلبة |
| 4 | التجمد | 5 | تحول المادة من الحالة الصلبة الى الغازية دون المرور بالحالة السائلة |
| 5 | التسامي | 2 | تحول المادة من الحالة الغازية إلى السائلة |
درجة غليان الماء تساوي ( ١٠٠ )
درجة تجمد الماء تساوي ..( صفر )
الدرس الخامس عشر : سلوك الموائع
رقم الصفحة في الكتاب : ٨٣-٨٦
تعريف المائع : هو كل مادة تمتاز بخاصية الجريان ( سائل ) و الانتشار ( غاز ) .
الضغط : هو القوة المؤثرة على سطح ما مقسومة على مساحته .
*حساب الضغط
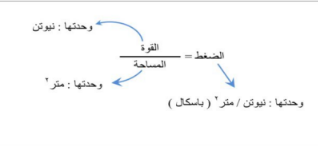
العوامل المؤثرة على الضغط:
١ -القوة يزداد الضغط بزيادة القوة ( تناسب طردي )
٢ -المساحة يزداد الضغط بنقصان المساحة ( تناسب عكسي )
مثال : أحسب الضغط الناتج عن قوة مقدارها ٢٥ نيوتن وتؤثر على سطح مساحته ١٠ متر تربيع ؟
الجواب : ٢٥/١٠ =٢٫٥ نيوتن / م تربيع
واجب
أحسب الضغط الناتج عن قوة مقدارها ٤٥ نيوتن وتؤثر على سطح مساحته ٢٠ متر تربيع ؟
الضغظ الجوي : هو ضغط الهواء
فائدته : يساعد في الشرب بالماصة ويبلغ مقداره عند سطح البحر ١٠١٫٣ كيلو باسكال
يقل الضغط الجوي بزيادة الارتفاع ويزداد بنقصان الارتفاع
الدرس السادس عشر تابع سلوك الموائع
الطفو والانغمار
تعريف قوة الدفع : هي قوة تؤثر إلى اعلى في الجسم الموجود في مائع .
السؤال : متى يطفو الجسم ومتى ينغمر ؟
الجسم يطفو عندما تكون ( قوة الدفع = قوة الجسم )
الجسم ينغمر عندما تكون ( قوة الدفع أصغر من وزن الجسم )
مبدأ ارخميدس هو قوة الدفع الموثرة في جسم داخل مائع تساوي وزن المائع الذي يزيحه الجسم
الكثافة هي مقدار كتله الجسم مقسومة على حجمه
ملاحظة مهمة * يساعد فهم الكثافة على توقع طفو الجسم او انغماره
1-كثافة الجسم أكبر من كثافة المائع الجسم ينغمر
2- كثافة الجسم أقل من كثافة المائع الجسم يطفو
3- كثافة الجسم تساوي كثافة المائع يبقى الجسم عالق داخل المائع
مبدأ باسكال هو الزيادة في الضغط على مائع محصور والناتج عن قوة خارجية تنتقل بالتساوي الى جميع أجزاء السائل .
1- مثل رافعة السيارات و كرسي طبيب الاسنان
2- فائدته رفع الاجسام الثقيلة بواسطة قوى صغيرة
مضخات القوة هي وعاء يسمح باندفاع المائع من خلال ثقب عند بذل ضغط على الوعاء
مثل علبة معجون الاسنان و القلب
تقويم : المادة
رقم الصفحة في الكتاب : 70 -91
السؤال : حـدد الإجـابـة الـصـحـيـحـة:
1 تحول المادة من الحالة الصلبة الى الحالة السائلة
A الأنصهار ( صح )
B التبخر
C التجمد
D التسامي
2 تحول المادة من الحالة السائلة الى الحالة الصلبة
A الأنصهار
B التبخر
C التجمد ( صح )
D التسامي
3 تحول المادة من الحالة الغازية الى الحالة السائلة
A الأنصهار
B التكاثف ( صح )
C التجمد
D التسامي
4 تحول المادة من الحالة الصلبة الى الحالة الغازية دون المرور بالحالة السائلة
A الأنصهار
B التبخر
C التجمد
D التسامي ( صح )
السؤال : عدد حالات المادة ؟
الجواب : ١ -الصلبة ٢ -السائلة ٣ -الغازية ٤ -البلازما
السؤال : جسم مساحة سطحه ٣م اثرت بقوة مقدارها ٢٧٠ نيوتن احسب مقدار الضغط الواقع عليه ؟
الجواب :
الضغط = القوة / المساحة
الضغط = 270/3=90باسكال
السؤال : ضع المصطلح العلمي المناسب امام كل جملة ؟
| كل مايشغل حيز وله كتلة | المادة |
| الخاصية التي تعبر عن مقاومة السائل للجريان | اللزوجة |
| هي مجموع طاقتي الوضع والحركة لجميع جسيمات الجسم | الطاقة الحرارية |
الدرس السابع عشر : ما الطاقة
رقم الصفحة في الكتاب : 102 -106
تعريف الطاقة : هي المقدرة على انجاز شغل او احداث تغير
الطاقة الحركية : هي الطاقة التي يمتلكها الجسم بسبب حركته .
تعتمد الطاقة الحركية على :
١ -سرعة الجسم ٢ -كتلة الجسم
طاقة الوضع :هي طاقة مختزنة في الجسم بسبب موضعه .
تعتمد طاقة الوضع على :
١ -الارتفاع عن سطح الارض ٢ -كتلة الجسم
أشكال أخرى للطاقة :
| الرقم | الطاقة | تعريفها |
| 1 | الطاقة الحرارية | هي الطاقة التي تمتلكها جميع الاجسام وتزداد بزيادة درجة حرارة الجسم |
| 2 | الطاقة الكيميائية | هي طاقة مخزنة في الروابط الكيميائية بين ذرات الروابط الكيميائية |
| 3 | الطاقة الضوئية | هي الطاقة التي يحملها الضوء |
| 4 | الطاقة الكهربائية | هي الطاقة التي يحملها التيار الكهربائي |
| 5 | الطاقة النووية | هي الطاقة المخزنة في انوية الذرات |
الدرس الثامن عشر : تحولات الطاقة
التحول هو تغير في بنية المادة أو تركيبها
* قانون حفظ الطاقة : الطاقة لاتفنى ولاتستحدث من عدم ولكن تتحول من شكل لاخر
*المصدر الرئيسي للطاقة في الأرض هي الشمس
الطاقة تغير شكلها :
| نوع تحول الطاقة | مثال | اشكال الطاقة المختلفة اثناء التحول |
| تحولات الطاقة الكيميائية |
تحول الطاقة في تحول الطاقة في |
كيميائية – حركيه – حرارية كيميائية – حركيه – حرارية |
| تحولات الطاقة الكهربائية | المذياع | كهربائية ( المذياع ) – حركية ( الهواء وطبلة الاذن ) – كهربائية ( إشارات عصبية ) -حرارية |
| تحولات الطاقة الحرارية |
الاحتراق ( الشمعة ) التيار الكهربائي المدفأه المصباح سلك فلزي |
كيميائية – حرارية – ضوئية كهربائية - حرارية كهربائية – حرارية كهربائية – حرارية – ضوئية اشعاعية كهربائية – حرارية – ضوئية اشعاعية |
الدرس التاسع عشر : تابع تحولات الطاقة
رقم الصفحة في الكتاب 112 -114
تعريف المولد الكهربائي : جهاز يحول الطاقة الحركية الى طاقة كهربائية
يتركب المولد الكهربائي من :
١ -ملف الاسلاك ٢ -مجال مغناطيسي
*التوربين هو مجموعة من شفرات المراوح وتستخدم في تحريك الملف وإنتاج طاقة

اوراق عمل مادة العلوم الصف الثاني المتوسط | الفصل الدراسي الاول
مواد دراسية مشابهة
تسجيل الدخول
